Stage de spectrographie - Session 2 (1/4)
LA CONSTRUCTION D'UN SPECTROGRAPHE
Aude - Bonjour Christian, Raymond, Alain. Vous avez vu lors de la session précédente de ce stage qu'il est possible de réaliser de l'analyse spectrale d'objets astronomiquement sans trop d'effort. Dans cette session nous allons apprendre à concevoir et utiliser un spectrographe un peu plus évolué, qui va offrir comme il se doit de nouvelle possibilité.
Raymond - Chic, ça me plaît. Avec un tel engin j'ai pouvoir d'observer le Soleil, les étoiles, les nébuleuses, les galaxies...
Aude - Je t'arrête Raymond. Tu me parais très enthousiaste et je ne veux pas briser cela. Mais sache que le grand dilemme de la spectrographie est le compromis entre la résolution spectrale et la capacité d'observer des objets faibles. On a entrevu cette problématique lors de la première session.
Christian - Avant de faire de la technique, j'aimerais que tu nous en dises plus sur la signification physique des couleurs que l'on voit dans un spectre.
Aude - D'accord, c'est important - je vais faire quelques rappels et entrer un peu plus dans les détails. La couleur trahit une caractéristique fondamentale de la lumière. La perception visuelle des couleurs par est liée à la manière dont l'oeil traduit cette caractéristique physique. Au lieu de parler de nuances colorés, une notion assez subjective, on a déjà vu que les physiciens préfèrent parler de longueur d'onde. Ils représentent souvent la lumière comme une onde sinusoïdale qui se propage dans l'espace à la vitesse de 299792,458 km/s. C'est la distance parcourue sur une période de cette sinusoïde que l'on appelle longueur d'onde. Cette quantité est généralement désignée par la lettre grecque l (lambda). Voici par exemple deux ondes lumineuses avec des longueurs distinctes l1 et l2 :
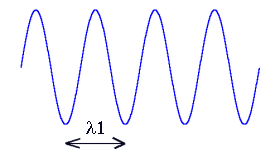
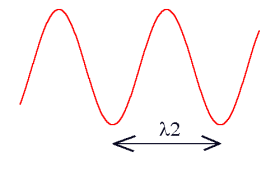
Les courtes longueurs d'ondes sont associées à la couleur bleue dans le spectre visible, alors que les grandes longueurs d'ondes produisent la sensation de rouge. Ce qui est vraiment important à comprendre c'est qu'à chaque couleur perçue par l'oeil est associée une longueur d'onde. Voici les valeurs usuelles de cette longueur pour le spectre visible en nanomètre (1 nanomètre = 1.10-6 mm).

Par exemple, un rayon lumineux de longueur d'onde de 450 nm sera vu par l'oeil d'un bleu extrêmement profond. Cette longueur est petite : 0,45 micron, ou si on préfère un 450 milliardièmes de mètre ! Un capteur CCD courant peu détecter quant à lui la lumière jusqu'à une longueur d'onde de 1000 nm, ce qui double pratiquement le domaine spectral observable par rapport à ce que voie l'oeil.
Alain - Tu nous a dit que la longueur d'onde pouvait s'exprimer dans une unité bizarre, en angströms. C'est bien ça ?
Aude - Oui, tout à fait. L'angström est une unité de longueur fort usitée par les spectrométriste. On la note par la lettre Å. Il y a une relation simple entre l'angström et le nanomètre : 1 Å= 0,1 nm. Le milieu du spectre visible correspond ainsi à une longueur d'onde de 5700 angströms environ.
Christian - Tous les objets lumineux ont un spectre alors ?
Aude - Oui, mais l'allure de ce spectre peut être très différente d'un objet à l'autre. Avec la plupart des étoiles, un examen rapide du spectre montre que celui-ci passe régulièrement du bleu au rouge, sans interruption des couleurs. On dit que le spectre est continu. En y regardant de plus près, on constate que généralement le spectre comprend des zones étroites où la lumière est pratiquement absente. On appelle ces zones des raies d'absorption. Elles sont la signature spectrale des éléments chimiques présents dans l'atmosphère de l'étoile. Dans certaines conditions physiques, les raies apparaissent en émission, c'est à dire plus lumineuses que le continuum qui les entoure. Le spectre simulé ci-après montre à la fois des raies en absorption et une raie en émission dans le rouge, cette dernière, à la longueur d'onde de 6563 angströms, étant probablement provoquée par les atomes d'hydrogène.

L'enregistrement des spectres permet d'identifier à distance les éléments constituant l'objet observé et les conditions physiques qui règne dans le milieu où est produite cette lumière. Cela montre l'intérêt considérable de la spectrographie, notamment en astronomie...
Christian - Je t'arrête Aude. Qu'est-ce qui te permet de dire qu'une raie est associée à l'hydrogène dans ton exemple ?
Aude - J'ai été un peu vite. Pour comprendre il faut pénétrer dans la structure intime de l'atome. Prenons l'exemple de l'atome d'hydrogène, le plus simple. Il est constitué d'un noyau autour duquel gravite un électron sur une orbite circulaire à une certaine distance du noyau. C'est une vision simpliste et très imagée de ce qu'est un atome, mais correcte pour expliquer bon nombre des phénomènes observés en spectrographie. L'électron peu changer d'orbite sous certaines conditions, mais les rayons de ces orbites ne peuvent être quelconques. Les rayons des orbites sont codifiés, on dit en physique, quantifiés. Un électron ne pourra ainsi circuler de manière stable que sur quelques orbites prédéfinies. Les atomes de tous les éléments chimiques suivent des orbites du même type, mais en fonction de l'élément chimique, les rayons de ces orbites stables ne seront pas les mêmes. Cette différence est fondamentale, car c'est elle qui permet de distinguer tel ou tel éléments chimiques dans un spectre en analysant la position des raies.
Christian - D'accord, mais je ne vois toujours pas ce qui produit ces raies !
Aude -
J'y viens. Pour qu'un électron passe d'une orbite stable inférieure
à une orbite stable supérieure, c'est à dire vers un plus
grand rayon, il est nécessaire de lui transmettre de l'énergie.
C'est la même énergie que vous devez dépenser lorsque vous
montez un barreau d'une échelle. Or, il se trouve que la lumière
porte en elle cette énergie nécessaire, qui est, c'est important,
d'autant plus grande que la longueur d'onde est courte. A présent, lorsqu'un
rayon lumineux passe à proximité d'un atome il peut transférer
une partie bien précise de son énergie à l'électron,
juste nécessaire pour l'amener d'une orbite inférieure à
une orbite supérieure donnée. Cette énergie est transformée
en quelque sorte en effort mécanique pour faire grimper l'électron
et elle disparaît alors du faisceau lumineux, car absorbée par
l'atome. La couleur correspondante dans le spectre apparaîtra noire. C'est
cela une raie spectrale. Voici une illustration de ce qui se passe. Le noyau
est en orange et l'électron en violet. Suite à un apport d'énergie,
sous la forme d'une onde lumineuse, l'électron monte sur une des orbites
permises.
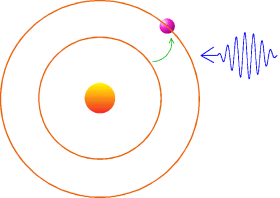
Christian - Cette couleur est toujours la même alors ?
Aude - Oui, pour un élément chimique donné et un changement d'étage donné. Mais dans un même atome, un électron peut très bien sauter directement de l'étage 1 à l'étage 3 par exemple. Pour cela il faudra qu'il absorbe une énergie supérieure, de la même manière qu'il faudra dépenser plus d'énergie pour monter deux barreaux sur une échelle plutôt qu'un seul. Une nouvelle raie va apparaître dans le spectre, correspondant à l'énergie nécessaire pour réaliser ce changement d'orbite. De très nombreuses combinaisons sont possibles. Par exemple, un électron peut passer de l'orbite 3 a l'orbite 4 ou directement de l'orbite 2 à l'orbite 4, et ainsi de suite. A chacune de ces combinaisons est associée une raie spectrale spécifique dans le spectre.
Raymond - Toutes ces raies sont donc visibles simultanément dans le spectre !?
Aude - Non, c'est plus compliqué. Tout d'abord il faut que l'énergie qui permet de faire sauter un électron d'un étage inférieur à un étage très supérieur soit disponible, ce n'est pas toujours le cas. Sous certaines conditions de pression et de températures certains changement de niveau, on parle aussi de transitions atomiques, sont plus probables que d'autres. La non-présence des raies d'un élément chimique dans le spectre ne signifie pas nécessairement que cet élément est absent du corps étudié, simplement, les conditions physiques ne sont pas favorables pour que sa "signature" spectrale soit visible. Ceci explique pourquoi le spectre des étoiles froides et des étoiles chaudes est si différent, alors que la composition chimique de l'ensemble des étoiles est relativement proche.
Christian - Et l'origine des raies en émission alors ?
Aude - C'est le processus inverse. Lorsque l'électron passe d'une orbite supérieure à une orbite inférieure il émet une sorte de bouffée d'énergie qui prend la forme d'une onde de lumière, que l'on appelle aussi quanta de lumière ou photon. L'énergie transportée dans l'onde correspond à une raie ayant une position précise dans le spectre, prédite dans le cadre d'une discipline de la physique que l'on nomme mécanique quantique. Dans l'illustration je vous montre la création d'une onde lumineuse suite au passage d'un électron d'une orbite supérieure à une orbite inférieure :
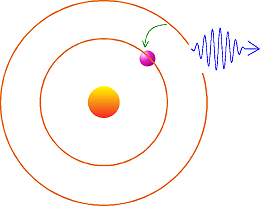
Cette onde porte une énergie bien précise prédite par la mécanique quantique pour la transition de l'électron en question. Vous pouvez voir aussi la lumière comme un grain d'énergie se déplaçant à environ 300 000 km/s. Ce grain c'est la particule que l'on nomme photon. Pour faire la liaison avec le spectre vous pouvez attribuer une couleur à un photon : un photon bleu sera plus énergétique qu'un photon rouge.
Christian - Avec les raies en émission, suivant l'orbite de départ et l'orbite d'arrivée, la longueur d'onde de la lumière sera différente, tout comme pour l'absorption ?
Aude - Exactement. Mais chaque atome d'un élément chimique produit son propre spectre d'onde, une véritable empreinte, qui est tout à fait distincte de celles des autres éléments.
Alain - Tu as des exemples ?
Aude - Oui. Regardez ces spectres. Le premier est un spectre continu, sans aucunes raies. Puis de haut en bas vous avez le spectre d'émission de l'hydrogène, de l'hélium, du sodium et de l'argon. Aucun ne se ressemble.





Christian - En effet !
Alain - Le spectre de l'argon contient un nombre incroyable de raies ! Ca a l'air simple finalement d'identifier un élément chimique dans un spectre. Il suffit d'avoir son modèle de raies.
Raymond - Il existe donc des catalogues de raies spectrales ?
Aude - C'est vrai que la signature spectrale des éléments chimiques se différencie bien. On trouve dans des tables ou dans certains logiciels des catalogues de toutes les raies par élément chimique. Mais vous devez imaginer la complexité du problème d'identification si l'objet étudié contient potentiellement tous les éléments chimiques. Les spectres individuels sont alors susceptibles de ce mélangés en un seul. Pas facile de reconnaître les raies dans tout ce foisonnement, croyez-moi. C'est vraiment un sport difficile, réservé aux spécialistes. En temps qu'amateurs, vous n'aurez pas en principe à faire l'analyse chimique dans un corps inconnu. Il sera bon cependant de pouvoir reconnaître la présence des éléments chimique les plus courants dans les objets du ciel, comme l'hydrogène par exemple. Votre travail consiste plutôt à étudier une poignées de raies seulement, dont on sait à l'avance quels sont les éléments chimiques qui les produisent et qu'elles sont leurs longueurs d'ondes.
Alain - Je comprends bien à présent le processus de production des raies, mais le spectre continu avec toutes ces nuances de couleurs, je ne vois pas d'où il vient !
Aude - Un spectre de raies n'est possible que si les atomes baignent dans un gaz très dilué. C'est une condition que l'on rencontre par exemple dans la chromosphère ou la couronne d'une étoile. Si la densité de la matière augmente et même à la limite, lorsque l'objet devient un solide, c'est l'agitation thermique des atomes qui est la cause des transitions atomiques. On montre que dans ce cas le corps émet une gamme continue d'énergie. Suivant que le corps est chaud ou froid le spectre d'énergie émis favorisera plutôt les rayons bleus ou rouges respectivement. C'est l'origine de la couleur des étoiles.
Alain - Il suffit q'un corps soit chaud pour qu'il émette de la lumière ?
Aude - Oui, et ceci est bien sur valable pour des solides. Par exemple, ne soyez pas étonné que je vous dise que vos corps émettent de la lumière. Mais cette lumière n'est pas visible, car elle correspond au domaine spectral infrarouge. Si mes yeux étaient sensibles dans l'infrarouge, je vous verrai par l'émission continue infrarouge que vous produisez à tout moment, même par nuit noire !
Pour être complet, je dirais qu'un autre mécanisme, lié aux vibrations des molécules, est susceptible de produire un spectre de raies. Dans le cas des étoiles, les molécules n'existent que si la température est relativement basse, en dessous de 3000 K en gros. Lorsque la température est plus haute la structure des molécules, qui est une association d'atomes, est brisée. On trouve aussi la présence du spectre des molécules dans les atmosphères planétaires, le gaz méthane par exemple dans le cas de Jupiter. Les raies moléculaires apparaissent très nombreuses et accolés les unes aux autres par paquets que l'on nomme des bandes.
Raymond - On voit comment les spectres prennent naissance. Mais tout à l'heure Christian t'a posé une question sur la notion de résolution spectrale et de luminosité d'un spectrographe. Je suppose que se sont des caractéristiques de l'instrument qui permettent de mieux voir le spectre. Est-ce que tu peux préciser ?
Aude - Une caractéristique importante du spectrographe sera sa capacité à séparer des raies proches les unes des autres, afin par exemple de mieux distinguer l'empreinte des divers éléments chimiques qui constitue l'objet observé. On appelle pouvoir séparateur spectral la plus petite distance entre deux raies qui permet de distinguer la duplicité. Par exemple, un pouvoir séparateur de 1 angstroms permettra de détecter la présence de deux raies distante de 1 angstroms dans le spectre. Si la distance entre ces deux raies est plus petite, l'observateur n'en verra qu'une seule, les deux composantes étant confondues. On dit que les raies ne sont séparées. Il y a donc une sorte de brouillage de l'information dans ce cas.
Raymond - Le meilleur spectrographe sera donc celui qui permettra de mieux séparer les raies. C'est comme avec un télescope de qualité qui permettra de voir de fins détails sur le disque de la planète Jupiter.
Aude - Au premier abord, on a tout intérêt en effet à viser un pouvoir séparateur permettant d'écarter au maximum les raies. Je rebondie cependant sur ton analogie avec l'observation visuelle de Jupiter. Pour bien résoudre les détails tu va devoir travailler avec un fort grossissement. Mais si tu conserve ce même grossissement pour observer une faible galaxie tu risque de ne rien voir du tout. En effet, le grossissement de l'instrument est tel que tu va diluer dans le champ de l'oculaire la pâle lumière de la galaxie. De manière naturelle tu va être obligé d'adopter un grossissement bien plus faible. Cela se fera au détriment de la finesse des détails perçus, mais au moins la galaxie deviendra visible, ce qui est bien l'essentiel. Nous avons le même problème en spectrographie : soit choisir une très bonne résolution spectrale, ce qui nous limite à l'étude d'objets brillants, soit choisir une basse résolution spectrale et privilégier la luminosité, ce qui permettra de saisir le spectre d'objets faibles.
Alain - En fait, on retrouve donc la notion de grossissement dans un spectrographe...
Aude - Oui, sauf qu'il s'agit ici d'une sorte de grossissement spectral. Il y a malheureusement un problème technique : il n'est pas facile de changer "l'oculaire" d'un spectrographe. Généralement ce sera un instrument assez spécialisé pour étudier tel type d'objet avec telle résolution. Le spectrographe universel qui permet de tout faire n'existe pas.
Alain - Je retrouve cela avec les télescopes. Suivant leurs conceptions, ils sont plus ou moins aptes à faire de la haute résolution ou des objets faibles.
Aude - Exact.
Raymond - Cela signifie qu'il faut se spécialiser ?
Aude - Oui, compte tenu de l'optimisation nécessaire de l'instrument en fonction de la brillance des objets étudiés ; mais aussi parce que le sujet est extrêmement vaste et que votre carrière d'astronome n'y suffira pas ! Mais rien ne vous empêche de construire plusieurs spectrographes si vous le souhaitez...
Alain - Qu'est-ce que tu nous conseille alors comme spectrographe, et pour quel type d'observations ?
Aude - Je vous propose un spectrographe ayant un pouvoir de résolution relativement modeste, pouvant séparer des raies distantes de 10 angstroms environ. L'intérêt est que vous pourrez monter ce spectrographe directement au foyer d'un télescope relativement modeste, disons de la classe d'un LX200 de 8 pouces, comme le tiens Christian. Il sera suffisamment lumineux pour pouvoir enregistrer des spectres interprétables d'étoiles de magnitude 13 au moins, toujours avec un télescope de 200 mm. Cela donne accès à bon nombre d'étoiles ! Vous avez alors la puissance suffisante pour étudier le spectre d'un très grand nombre d'étoiles variables, des novae, des comètes brillantes. Vous pourrez aussi prendre le spectre de nébuleuses diffuses et planétaires. En revanche, la plupart des supernovae se déroberont... à moins d'utiliser un télescope de la classe d'un 500 ou 600 mm. De la même manière, la résolution spectrale sera insuffisante pour étudier finement le mouvement des gaz autour d'astres possédant des disques, comme la catégorie des étoiles Be. Cependant, pour ce dernier type d'objet, vous serez en mesure de fournir des mesures spectrophotométriques de première importance.
Christian - Ca te parait les meilleures options pour débuter en spectroscopie ?
Aude - C'est bien sur un peu subjectif car à chacun ces goûts. La classe de performance que je viens de décrire est je pense un bon compromis entre le prix du spectrographe et la facilité d'utilisation d'une part, et l'étendu des observations réalisables d'autre part. Le maître mot du dimensionnement que je vous propose est la compacité et le poids le plus faible possible. De toute manière, je vais essayer de vous donner le schéma de base d'un spectrographe, et il sera facile à partir de là de calculer l'instrument qui vous parait le plus opportun.
Retour à la page d'accueil du stage Page précédente Page suivante