QUELQUES RAPPELS DE PHYSIQUE NUCLEAIRE
La matière de notre Univers est constituée d'atomes de différents
éléments. Ces éléments sont classés dans la fameuse table
de Mendeleïev, qui est accrochée dans toutes les salles de
chimie de tous les lycées de la Terre. Chaque élément
est représenté par un symbole (par exemple Na pour le sodium
ou O pour l'oxygène), associé à deux nombres : le numéro atomique
qui indique le nombre de protons (et donc le nombre d'électrons,
puisque qu'un atome est normalement neutre, et qu'il faut
compenser les charges positives des protons par autant de
charges négatives amenées par les électrons) et le nombre
de masse, qui indique le nombre de neutrons additionné du
nombre de protons.
Un noyau ( ou un atome ) est représenté ainsi : 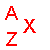 avec A = N + Z , A étant le nombre total de nucléons ( protons
+ neutrons ).
avec A = N + Z , A étant le nombre total de nucléons ( protons
+ neutrons ).
Pour un même élément, le numéro atomique ne change pas. Par
contre, le nombre de masse peut varier, et on a alors à faire
à des isotopes de l'élément. Par exemple, l'hydrogène (un
proton) possède deux isotopes : le deutérium (un proton, un
neutron) et le tritium (un proton, deux neutrons). Les isotopes
présentent les mêmes propriétés chimiques (car celles-ci dépendent
principalement du nombre d'électrons, qui est le même pour
tous les isotopes d'un même élément), mais différent par leurs
propriétés physiques. Le tritium, qui possède deux neutrons
de plus que l'hydrogène, est par exemple plus lourd que ce
dernier.
Si certains isotopes sont stables, d'autres sont radioactifs
: ces atomes instables ont alors tendance à se désintégrer
spontanément pour donner naissance d'une part à un
rayonnement et d'autre part à un isotope plus stable
ou un autre élément. La stabilité d'un élément est en particulier
conditionné par son nombre de neutrons : si ces derniers sont
présents en quantité trop importante, l'atome aura tendance
à se débarrasser de cet embonpoint en éjectant un ou plusieurs
neutrons. La désintégration radioactive est totalement indépendante
de l'environnement de l'élément, et se déroulera de façon
constante quelque soit la pression, la température, l'acidité
du milieu, etc. Elle est caractérisée par le temps de demi-vie
de l'élément en question (que l'on appelle aussi période),
c'est à dire le temps nécessaire pour que la concentration
de l'élément soit divisée par deux.
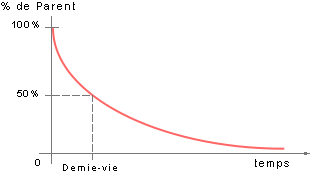
La réaction de désintégration d'un élément donné n'est pas
constante: elle est très rapide au début, et sa vitesse décroît
par la suite, selon cette courbe générale : Pour plus de commodité,
on utilise un paramètre qui permet d'avoir des ordres de grandeur
: la demi-vie d'un élément radioactif. La demie-vie est le
temps nécessaire pour que la moitié de l'élément-parent soit
désintégrée. Attention, ce n'est pas la moitié de la vie de
la désintégration, mais bien le temps nécessaire pour que
la moitié de l'élément-parent soit désintégrée. Voici quelques
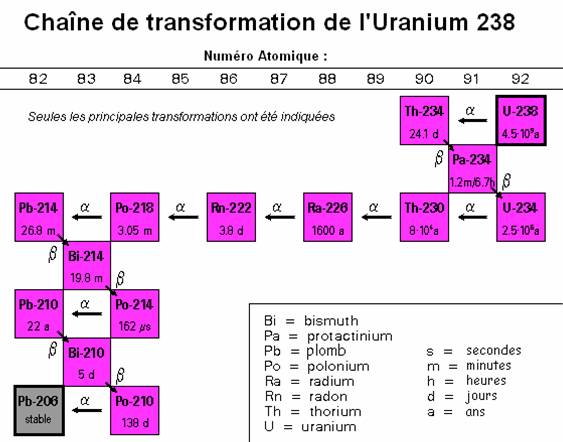
exemples de désintégrations couramment utilisées :
RADIOACTIVITE ET DATATION DES
ROCHES :
La radioactivité est extrêmement intéressante, car elle va
permettre la datation absolue des roches. La méthode la plus
célèbre dans ce domaine est la datation des restes organiques
au carbone 14 (14C). Le physicien américain F.N.F
Kurie découvre par hasard l'isotope 14 du carbone en 1934,
lorsqu'il expose de l'azote à un flux de neutrons. Mais, c'est
à Willard Libby, que l'on attribue la découverte du carbone
14 en 1946, et l'idée de sa future utilisation : Libby émet
l'idée de la production continue de cet isotope dans la nature
et établit alors les bases actuelles théoriques et pratiques
de son utilsation dans le domaine archéologique. Il obtient
ses premiers résultats en 1949, que H.L. De Vries améliore
par la suite. Ces résultats mettent en évidence toutes les
possibilités de cette nouvelle méthode de datation. Cette
découverte vaut à Libby le Prix Nobel de chimie en 1960.

Libby après l'attribution du prix Nobel : il semble
content...
L'atome de carbone possède normalement 6 protons et 6 neutrons
(carbone 12). Mais on lui connaît deux isotopes, le carbone
13 (6 protons, 7 neutrons) et le carbone 14 (6 protons, 8
neutrons). Les atomes de carbone 14 (dénommé isotope père)
se transforment spontanément pour donner naissance à des isotopes
stables, que l'on appelle isotopes-fils. Le temps de demi-vie
du carbone 14 est de 5730 ans (au bout de cette période, la
quantité de carbone 14 présent dans un matériau est donc réduite
de moitié).
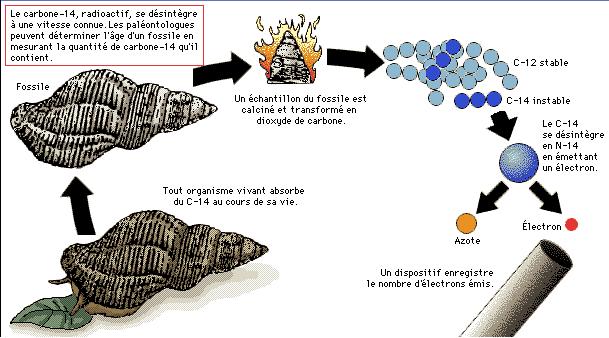
En mesurant la quantité d'isotopes-père (carbone 14) et d'isotopes-fils,
il est possible de connaître l'âge de l'échantillon analysé.
Pour que l'analyse soit valable, il faut cependant que le
carbone 14 qui s'est transformé au cours du temps n'ait pas
été renouvelé. Les atomes de carbone 14 se forment en effet
en permanence dans la haute atmosphère, sous l'effet du rayonnement
cosmique. Chaque être vivant en assimile, et la quantité de
carbone 14 dans un organisme vivant reste donc constante.
Ce n'est qu'à la mort de l'organisme en question que l'assimilation
de carbone 14 cesse : l'horloge isotopique se met alors à
zéro, et la quantité de carbone 14 commence à décroître lentement.
Chaque 5730 ans, elle sera divisée par deux. Mais le carbone
14 (demi-vie de 5730 ans) ne marche pas pour des durées supérieures
à 50 000 ans.
Pour dater des météorites, on doit utiliser des horloges
à plus longue période que le carbone 14, car celui-ci ne permet
de dater que des objets dont l'âge est inférieur à 50 000
ans (soit environ dix fois le temps de demi-vie). On utilise
par exemple les couples uranium 238 / plomb 206 (238U
/ 206Pb, période de 4,5 milliards d'années), potassium
40 / argon 40 (40K / 40Ar, période de
1,26 milliards d'années) ou encore rubidium 87/ strontium
87 (87Ru / 87Sr, période de 48,8 milliards
d'années). Nous avons vu que dans le cas du carbone 14, l'horloge
isotopique s'initialise lors de la mort de l'organisme. Dans
le cas d'un matériau rocheux, l'horloge se met à zéro lorsque
la roche se solidifie.
Pour détecter les différents isotopes, on utilise un spectrogramme
de masse. L'échantillon du corps que l'on veut étudier est
placé dans une enceinte sous vide et chauffé. Les atomes sont
vaporisés puis ionisés (c'est à dire qu'ils acquièrent une
charge suite à la perte ou au gain d'un ou plusieurs électrons).
Les ions formés sont alors capables d'être accélérés et déviés
par un champ magnétique. Plus l'ion est lourd, moins il sera
dévié. A la sortie de l'appareil, on place des détecteurs
spécifiques aux ions dont on désire déterminer la concentration.
Grâce à cette technique, on peut ainsi connaître la composition
atomique et isotopique d'un échantillon.
La sonde ionique est un instrument similaire au spectrogramme
de masse, mais la purification de l'échantillon n'est plus
nécessaire : celui-ci est bombardé par un faisceau d'ions
primaires, et les ions émis en retour sont étudiés selon le
principe du spectrogramme de masse. Les minéraux peuvent être
étudiés directement au sein de la roche, ce qui permet de
contrôler leur localisation et d'effectuer des comparaisons.
La sonde ionique est capable d'analyser des surfaces rocheuses
extrêmement petites (10 à 20 microns d'envergure).
LA DATATION DES METEORITES :
La radioactivité permet donc de connaître l'âge de formation
d'une météorite. Mais il est peut être également intéressant
de connaître l'âge d'exposition, c'est à dire la durée pendant
laquelle la roche a erré dans l'obscurité glacée de l'espace
interplanétaire (entre le moment ou elle a quitté le corps
parent et le moment ou elle est arrivée sur Terre). La connaissance
de l'âge d'exposition est possible grâce aux effets du rayonnement
cosmique. Pendant son séjour dans l'espace, la météorite est
effectivement bombardée par des particules à haute énergie
qui forment le rayonnement cosmique et qui peuvent modifier
la composition de la météorite. En déclenchant des réactions
nucléaires, les rayons comiques donnent naissance à de nouveaux
éléments, des noyaux cosmogéniques (le magnésium 24 se transformant
par exemple en néon 21), dont l'abondance permet de déduire
le temps que la météorite a passé dans l'espace.
Cette technique possède cependant un inconvénient majeur
: les rayons cosmiques ne peuvent effectivement pénétrer que
superficiellement une météorite, et leurs effets ne sont sensibles
qu'à quelques mètres de profondeur. Imaginons une météorite
de plusieurs mètres de diamètre, qui a vagabondé tranquillement
dans l'espace pendant 10 millions d'années. Si, juste avant
la fin de son périple, cette météorite se brise en morceaux
(à cause de la collision avec un autre corps) et que seul
son cour parvient sur Terre, nous allons être fortement induits
en erreur quant à la durée de son séjour dans l'espace. Le
cour de la météorite ne montrera effectivement aucun dégât
imputable aux rayons cosmiques, et les géochimistes en déduiront
donc que la météorite n'a passé qu'un temps très court dans
l'espace ...
Enfin, les géologues souhaitent également connaître le moment
ou une météorite s'est écrasée sur Terre. La technique le
plus efficace reste bien sur d'observer directement sa
chute. Malheureusement, de nombreuses météorites échouent
sur notre planète en l'absence de témoins. Les scientifiques
ont donc mis au point plusieurs techniques permettant de connaître
le temps passé par une météorite à la surface de la Terre.
L'une d'elles consiste à étudier les isotopes radioactifs
produit par le flux de neutrons (résultant de l'interaction
des rayons cosmiques avec la matière), comme le carbone 14
(14C) ou l'aluminium 26 (26Al).
Le carbone (entrant dans la composition du CO2) est très
répandu dans notre atmosphère. Ce carbone est constitué principalement
de carbone 12 , qui est stable, et d'une très faible proportion
de carbone 14 ( isotope du carbone 12 ) qui est radioactif
avec une période ou demi- vie de 5730 ans. Les divers échanges
( respiration, photosynthèse, alimentation) qui se produisent
entre l'atmosphère et le monde "vivant" ont pour effet de
maintenir la proportion Centre les quantités de C14 / C12
dans celui-ci idéntique à celle de l'atmosphère. Mais, dès
qu'un organisme meurt, le carbone 14 qu'il contient n'est
plus renouvelé. Sa proportion se met alors peu à peu à diminuer
à cause de sa radioactivité. La mesure du rapport du carbone
14 par rapport au carbone 12 permet donc de connaître la date
de mort d'un organisme bien après que celle ci est eu lieu.
Moins il reste de carbone 14 dans un échantillon à dater,
plus sa mort est ancienne.

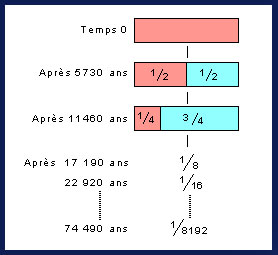
Au temps 0, on a 100% de 14C (barre rose). Après 5730 ans
(la demie-vie de la désintégration), la moitié du 14C est
désintégrée. Après un autre 5730 ans (11,460 ans au total),
la moitié de la moitié est désintégrée ; il reste le quart
du 14C originel. Après un autre 5730 ans, il en reste 1/8,
. et ainsi de suite. Après 74,490 ans, il reste 1/8192 (=
0,000122) du 14C originelle. C'est peu, d'autant plus qu'au
départ, la quantité de 14C par rapport au 12C était déjà faible.
Analyser une si faible quantité devient très difficile. En
pratique donc, le 14C est utile pour dater des objets qui
ne sont pas plus vieux que 75 000 ans. On parle ici non plus
en milliards, ni même en millions d'années, mais bien en quelques
dizaines de milliers d'années seulement.
|